5.2. Dans le Savoir Savant
La compétition entre les grands chimistes organiciens du début du XXe siècle se déroule en partie au sein de l’école anglaise avec Robert Robinson, Christopher Ingold et Arthur Lapworth. La première interprétation de la régiosélectivité de la bromation revient à Robinson en 1917 (Brown et all, 2001). Cette interprétation ne possède pas de caractère prédictif et ne constitue donc pas une théorie.
C’est à Lapworth qu’il faut rendre cet hommage pour son article de 1922 « Une démonstration théorique du principe de polarité alternée induite », dans lequel il explique le caractère électropolaire d’une chaîne d’atomes sans recourir à un quelconque mécanisme réactionnel (il ne le précise pas, mais il s’intéresse aux systèmes conjuguées). Les références à des articles contemporains de Thomson, Lewis, Langmuir etc. et bien sûr Robinson montrent, s’il est nécessaire, à quel point cette époque fertile a marqué les générations qui suivirent. Les flèches courbes apparaissent ainsi pour la première fois « pour indiquer les directions du mouvement des valences partielles vers ou depuis la liaison A0 A1 » (Lapworth nomme ainsi les deux premiers atomes de la chaîne − figure 1).
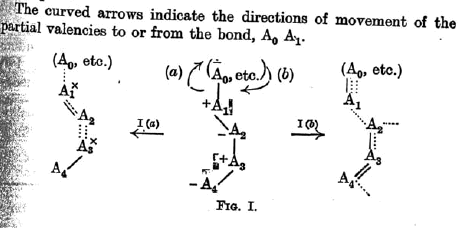
La théorie proposée par Lapworth n’a certes pas aboutie puisque l’on peut y lire par exemple que « certains atomes peuvent n’être, momentanément au moins, relié que par un électron ». A défaut, sa proposition a le mérite d’interpréter les polarités alternées (ce qui est toujours d’actualité même avec les calculs de charges partielles au moyen de théories orbitalaires) et de mettre en place la notation des flèches courbes, toujours utilisées.
Robinson ne tarde pas à réagir et, dans un article de 1925, il justifie la polarisation d’énamines puis propose un mécanisme pour des substitutions aromatiques telles que la diazotation. Une phrase telle que « la réaction du complexe polarisé » [il s’agit d’une forme chargée de résonance] peut intervenir de plusieurs façons dont l’une est la fixation d’un ion positif sur le centre négativement chargé suivi de l’expulsion d’un proton de l’ion complexe puis de la dépolarisation par le processus inverse » montre la vision claire qu’il possède du mécanisme de cette réaction. Comme le montre la figure 2, la représentation utilise une notation du noyau benzénique éloignée de celle admise de nos jours, mais le mécanisme est à peu de chose près celui qui est enseigné.
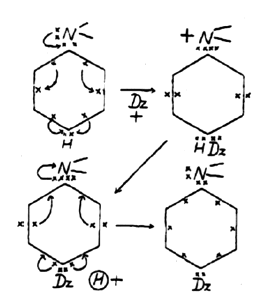
Dans cet article l’auteur classe les groupements en deux types : les premiers qu’il appelle «Crotonoid» sont responsable de la réactivité de certaines réactions (amines aromatiques, phénols,…) comme par exemple un carbonyle lié à un centre insaturé. Les seconds qu’il appelle «Cretonoid» sont capables d’augmenter leur valence comme par exemple l’azote (trivalent) lié à un centre insaturé. Dans ce cas Robinson utilise les flèches courbes pour le déplacement d’un doublet d’électrons et toutes les flèches sont dans le même sens (fig. 3) :
Mais dans le cas de la représentation des groupements contenant un noyau aromatique ces flèches sont utilisées pour le déplacement d’un seul électron et dans des sens contraires. De même dans le cas des mécanismes, s’il s’agit de réactions de molécules contenant un noyau aromatique, les flèches indiquent le déplacement d’un seul électron et en sens inverse (fig. 2).
Une année après (1926) une série de quatre articles du groupe de R. Robinson relatif au pouvoir d’orientation des groupes RO- et RR’N- dans les substitutions [électrophile préciserions-nous aujourd’hui] aromatiques a été publiée. Les trois premiers articles décrivent des synthèses et le quatrième consiste en une discussion du dit pouvoir d’orientation (Allan et al. 1926, p.401).
Robinson précise : « L’oxygène, au moyen de ses électrons libres, augmente sa covalence avec le Cα du cycle (processus (a)). Cα retrouve sa covalence normale en donnant les électrons correspondant à Cβ (processus (b)) (substitution en position ortho) ou en cédant1 les électrons de la covalence CαCβ a CβCγ (processus (c). Cγ doit alors céder les électrons de la covalence CβCγ au seul usage de Cδ (processus (d) (substitution en position para). […] ce dernier est intensément réactif et forme de nouvelles covalences. » Cette formulation est très proche de celle utilisée actuellement pour expliquer les règles de Holleman, à la différence près que l’enseignement actuel parle en termes d’augmentation de la vitesse, et que l’activation est discutée sur l’état intermédiaire, et non sur l’état initial.
A la même période, ces flèches ont été aussi utilisées pour représenter :
- L’effet mésomère (fig. 4) :
- Les formes tautomères (fig. 5) :
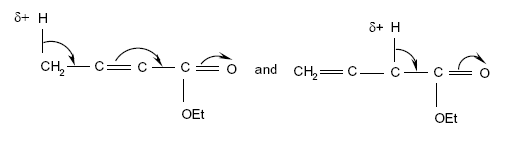
- Les formes mésomères (fig. 6 et 7) :
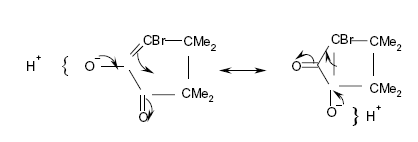
et
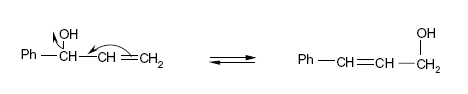
- Les mécanismes réactionnels (fig. 8) :
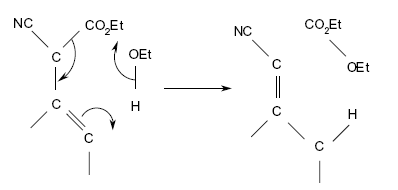
- Les centres réactifs des molécules :
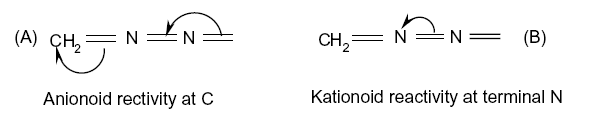
Ces articles sont peu représentatifs de la littérature entre 1926 et 1932 dans laquelle la quasi-totalité des auteurs ignorent cette notation. Il est remarquable de constater qu’aucun des articles présentés, et qui utilise les flèches courbes pour représenter les mécanismes, ne précisent ni leur utilisation ni leur signification. Ceci laisse penser que la symbolique utilisée semblait suffisamment explicite aux auteurs.