3.2.3. La dissociation des réseaux neuronaux en fonction des tâches de décision olfactives
Dans la plupart des travaux exposés ci-dessus, les auteurs ne proposent pas de tâche cognitive explicite aux sujets. L’absence de tâche ignore la nature des processus cognitifs mis en jeu par les sujets pendant l’expérience, et obscurcit l’interprétation des résultats. Cela peut de surcroît entraîner une moindre implication du sujet qui, faute de consignes, présente des difficultés à rester concentré.
Notre équipe, menée par Jean-Pierre Royet, est la première à étudier les activations cérébrales associées à une tâche de décision olfactive. A partir de concepts tirés de la psychologie cognitive (Craik & Lockhart, 1972; Craik & Tulving, 1975; Kosslyn & Koenig, 1992), Royet et ses collaborateurs proposent l’utilisation de tâches olfactives variées pour étudier les différents processus olfactifs (Royet et al., 1999; Royet et al., 2001b). L’idée fondamentale de cette approche est que les stimuli peuvent être analysés à différents niveaux, de l’analyse perceptive la plus superficielle aux traitements cognitifs les plus profonds. Ce point de vue est également suggéré, dans le domaine de l’olfaction, par Frank Schab (1991). Ainsi, l’auteur propose que le processus d’identification d’une odeur soit vu comme un continuum, allant de l’identification non verbale (familiarité et hédonicité) à l’identification de l’odeur par son nom, ou plutôt par le nom de sa source. Jean-Pierre Royet et Olivier Koenig , élargissent ce point de vue grâce à l’utilisation de nouvelles tâches olfactives et font l’hypothèse que la tâche de détection est un jugement superficiel n’impliquant pas le rappel des représentations olfactives stockées en mémoire, alors que les jugements de familiarité et d’hédonicité activent des représentations perceptives (Royet et al., 1999; Royet et al., 2001b). La tâche de jugement de comestibilité, quant à elle, représenterait un traitement profond de l’information olfactive et implique l’activation des représentations perceptives et sémantiques des odeurs. Les auteurs font aussi l’hypothèse que ces deux types de représentations sont stockées dans des systèmes neuronaux distincts, les informations perceptives étant stockées dans un réseau neuronal olfactif, et les représentations sémantiques des odeurs étant stockées dans une mémoire associative plurimodale.
Dans la mesure où la durée d’une séquence d’enregistrement de l’activité cérébrale en TEP ou en IRMf par bloc est de l’ordre de la minute, le stimulus odorant doit être présenté de façon répétée pour assurer une intensité de signal suffisante. Le recours à des tâches de décision olfactive implique alors que ces stimuli soient variés. Cela permet au sujet de rester concentré sur la tâche pendant toute la durée de la séquence, en évitant les problèmes d’habituation centrale (Démonet et al., 1993), et réduit le phénomène d’adaptation sensorielle, crucial en olfaction (Cain, 1970). Lors des premières études d’imagerie cérébrale, un nombre restreint de stimuli olfactifs (de 2 à 8) est utilisé pendant l’enregistrement de l’activité cérébrale. Le choix de ce nombre limité d’odorants est souvent dicté par des contraintes expérimentales, les auteurs ne disposant pas d’appareillage de stimulation 3 (olfactomètre) ; ils présentent alors simplement les odorants sur du coton ou dans des flacons. Deux olfactomètres sont utilisés outre-atlantique dans le contexte de l’imagerie cérébrale (Sobel et al., 1997; Lorig et al., 1999). Ils ont l’immense avantage de fonctionner en présence des forts champs magnétiques de l’IRM, mais ne délivrent cependant qu’un nombre limité d’odorants.
Afin de procéder à des études d’imagerie cérébrale, un olfactomètre est conçu dans notre laboratoire (Vigouroux et al., 2005, Annexe 1). Il permet à l’expérimentateur de délivrer des stimulations olfactives de façon synchrone à la respiration du sujet. Cette condition est essentielle parce que le sujet respire alors ‘naturellement’ pendant les tâches de décision. L’usage des deux olfactomètres cités plus haut implique qu’un signal visuel (ou auditif) informe le sujet de l’arrivée imminente d’un stimulus. Cela contraint les sujets soit à visualiser les signaux (et à garder les yeux ouverts), soit à les écouter, pendant la durée de l’expérience, et implique alors la mise en jeu de processus cognitifs visuels (ou auditifs) non spécifiques. Cela nécessite également que le sujet inspire ‘sur commande’, et non ‘naturellement’. A l’olfactomètre utilisé dans notre laboratoire peut être également adjoint un système d’enregistrement des réponses comportementales et physiologiques (respiration, rythme cardiaque, réponse électrodermale) du sujet (Vigouroux et al., 2005).
En utilisant leur olfactomètre, Royet et ses collaborateurs (Royet et al., 1999; Royet et al., 2001b) montrent une dissociation des circuits neuronaux en fonction de la tâche olfactive considérée. Ainsi, tandis que le cortex orbitofrontal droit est activé préférentiellement par la tâche de jugement de familiarité, le cortex orbitofrontal gauche est préférentiellement activé par la tâche de jugement d’hédonicité. Dans ces travaux, il est également montré que les processus olfactifs de haut niveau, tels que les jugements de familiarité et de comestibilité, activent le gyrus frontal inférieur gauche, ce que les auteurs interprètent comme l’activation des représentations sémantiques. Cette interprétation est corroborée par des travaux plus récents montrant l’activation de cette région lors de la perception passive d’odeurs familières (Savic & Berglund, 2004), et durant l’identification des odeurs (Kareken et al., 2003).
D’autres études d’imagerie cérébrale reposent sur l’utilisation de tâches explicites telles que celles de détection, de discrimination, de mémoire de reconnaissance, et d’identification (Dade et al., 1998; Qureshy et al., 2000; Savic et al., 2000; Suzuki et al., 2001; Dade et al., 2002; Kareken et al., 2003). Dans la plupart de ces études, les auteurs observent des activations dans plusieurs structures cérébrales autres que le cortex orbitofrontal, telles que le cortex piriforme, l’amygdale, l’hypothalamus, le cortex entorhinal, le gyrus cingulaire, l’insula, le thalamus, et le cervelet. Savic et al. (2000) examinent les patterns d’activation évoqués par les tâches de détection, de discrimination d’intensité, de discrimination de qualité, et de mémoire de reconnaissance des odeurs. Les auteurs montrent que les différentes tâches olfactives, tout en partageant une base neuronale commune constituée du cortex olfactif primaire et des aires qui lui sont directement liées, ont chacune des patterns d’activation spécifiques liés à leur niveau de complexité. De ces données, Ivanka Savic et ses collaborateurs suggèrent que les fonctions olfactives sont organisées d’une manière hiérarchique et parallèle en fonction de la nature de la tâche et de sa complexité.
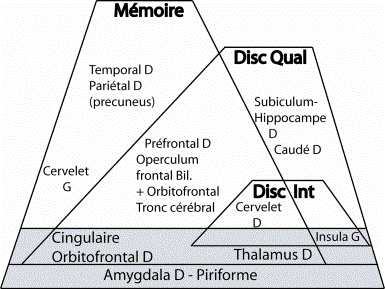
De ces premiers travaux d’imagerie cérébrale, deux axes majeurs d’études se dessinent selon que les expérimentateurs s’intéressent plutôt à la composante émotionnelle ou à la mémoire des odeurs. Nous allons examiner successivement les découvertes obtenues dans ces deux cas.