II. Le « système miroir »
II.1. Les neurones miroir chez le singe
Dans les années 90, l’hypothèse d’une origine motrice du langage a été remise au goût du jour et créditée par la découverte, par Rizzolatti et son groupe à l’université de Parme, des neurones dits « miroir » dans le cerveau des macaques (di Pellegrino et al., 1992 ; Gallese et al., 1996 ; Rizzolatti et al., 1996a). En ce qu’elle constitue une base neurophysiologique potentielle à l’émergence du langage humain, cette découverte a révolutionné le monde des neurosciences contemporaines.
‘“The discovery of mirror neurons is the single most important "unreported" story of the decade. I predict that mirror neurons will do for psychology what DNA did for biology: they will provide a unifying framework and help explain a host of mental abilities that have hitherto remained mysterious and inaccessible to experiments”. (Ramachandran, 2000).’Chez le singe, le cortex prémoteur latéral, désigné sous le nom d’aire 6 de Brodmann (BA 6), comprend, dans sa partie rostro-ventrale, une aire corticale particulièrement intéressante de par ses propriétés motrices (80 % de ses neurones) mais aussi visuelles (20 %), l’aire F5 (Matelli et al., 1985). Cette aire, directement connectée au cortex moteur primaire (F1 ou M1), code les mouvements de la main et de la bouche de manière somatotopique 2 : les mouvements manuels sont représentés dans sa partie dorsale et les mouvements buccaux dans la partie plus ventrale (Gentilucci et al., 1988 ; Hepp-Reymond et al., 1994 ; Kurata & Tanji, 1986 ; Rizzolatti et al., 1981, 1988). F5 constitue, avec l’aire intrapariétale (AIP), située dans la partie la plus rostrale de la berge latérale du sillon intrapariétal, l’un des éléments clés de la transformation visuo-motrice chez le singe (Figure 2.1) : en transformant les propriétés visuelles des objets en patterns moteurs, ces aires permettent aux singes d’interagir de manière appropriée avec ces objets de leur environnement (Arbib et al., 2000 ; Arbib, 2002, 2005 ; Fagg & Arbib, 1998 ; Jeannerod et al., 1995 ; Rizzolatti et al., 1988 ; Taira et al., 1990).
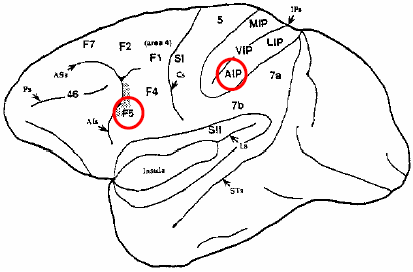
Les aires frontales agranulaires sont classées selon Matelli et al. (1985). AIP, aire intrapariétale ; Als, sillon arqué inférieur ; Ass, sillon arqué supérieur ; Cs, sillon central ; IPs, sillon intrapariétal ; LIP, aire intrapariétale latérale ; Ls, sillon latéral ; MIP, aire intrapariétale médiane ; PS, sillon principal ; SI, aire somatosensorielle primaire ; SII, aire somatosensorielle secondaire ; STs, sillon temporal supérieur ; VIP, aire intrapariétale ventrale. IPs et Ls ont été « dépliés » pour distinguer les différentes aires qui les composent. Pris de Rizzolatti et al. (1996a).
L’une des caractéristiques fondamentales des neurones de l’aire F5 est qu’ils déchargent sélectivement lors de la réalisation d’actions dirigées vers un but, tels que la saisie ou encore la manipulation d’objets (Jeannerod et al., 1995 ; Rizzolatti et al., 1988). En outre, la plupart de ces neurones sont activés indépendamment de l’effecteur utilisé (main droite, main gauche ou bouche) pour réaliser le but de l’action (e.g. saisie). En revanche, ils ne déchargent pas lorsque les mêmes effecteurs sont utilisés dans un but différent (e.g. pousser les objets). Par ailleurs, la majorité des neurones de F5 spécifient la manière d’atteindre le but visé, c’est-à-dire le type de configuration manuelle utilisé pour interagir avec les objets. Les mouvements de préhension sont en effet réalisés de différentes façons selon la taille de l’objet cible : la saisie d’un petit objet nécessite la formation d’une « pince de précision » (i.e. opposition du pouce et de l’index), celle d’un objet de taille moyenne d’une « pince avec les doigts » (ou « finger prehension », i.e. opposition du pouce et de tous les autres doigts), et celle d’un objet plus volumineux d’une « pince à pleine main » (ou « whole hand », i.e. flexion de tous les doigts autour de l’objet ; Gallese et al., 1996 ; Rizzolatti & Gentilucci, 1988). Certains neurones de F5 sélectifs de la saisie par exemple codent ainsi pour un type particulier de préhension (e.g. pince de précision) et ne déchargent que si la saisie de l’objet fait appel à ce type de préhension. En fonction de l’action pour laquelle ils codent, les neurones de F5 ont été classés en plusieurs catégories, les principales étant les neurones « de préhension avec la main », les neurones de « préhension avec la main et la bouche », les neurones « holding » (i.e. pour tenir), les neurones de « manipulation » et enfin les neurones « tearing » (i.e. pour déchirer).
Compte tenu de l’ensemble des propriétés motrices de ces neurones, Rizzolatti et ses collègues (1988) ont proposé que l’aire F5 contienne une sorte de « vocabulaire des actions » (Arbib, 1981), dont les populations de neurones constitueraient les « mots ». Certains mots détermineraient le type d’action à effectuer (i.e. préhension, manipulation etc.), d’autres spécifieraient la manière la plus appropriée d’interagir avec l’objet cible (i.e. pince de précision, avec les doigts etc.). Autrement dit, l’aire F5 stockerait des « actions potentielles », ayant conduit les auteurs à suggérer que l’activation de ses neurones ne conduise pas nécessairement à une action, mais évoque la représentation interne de cette action (Jeannerod, 1994 ; Rizzolatti & Fadiga, 2004).
Mais la découverte cruciale et inattendue, qui a réellement bouleversé le monde des neurosciences, est qu’une partie des neurones de F5 (20 %) possède, outre les propriétés motrices décrites ci-dessus, des propriétés visuelles. Deux classes de neurones sont distinguées : les « neurones canoniques » et les « neurones miroir ». Après avoir brièvement introduit les propriétés visuelles des neurones canoniques, nous nous attarderons plus longuement sur celles des neurones miroir.