II.3.4. Etudes d’imagerie cérébrale
L’IRMf et la TEP sont des techniques hémodynamiques basées sur le principe fondamental que toute augmentation de l’activité neuronale est associée à une augmentation régionale du débit et du volume sanguins. Ainsi, lors de la réalisation d’une tâche, les aires impliquées dans cette tâche consomment de l’oxygène et des nutriments, cette consommation pouvant être détectée grâce à l’imagerie cérébrale. Il est alors possible d’associer ces régions corticales ou sous-corticales particulières à la réalisation de la tâche en cours. Alors que l’IRMf exploite les variations de débit sanguin au travers des changements d’oxygénation du sang, la TEP, plus invasive, nécessite l’injection de traceurs radioactifs (eau ou déoxyglucose marqués) permettant de mesurer le débit sanguin ou encore la consommation neuronale de glucose. Ces techniques se caractérisent par une très bonne résolution spatiale (de l’ordre du millimètre), permettant de localiser les activations corticales de manière très précise, mais une résolution temporelle d’une à quelques secondes, c'est-à-dire insuffisante au regard du « timing » cognitif de l’ordre de la dizaine de millisecondes. Il est néanmoins important de noter que le potentiel de localisation des activations en imagerie cérébrale est souvent surestimé au détriment de ses limites, les biais méthodologiques étant nombreux (e.g. déformations de la surface corticale lors du recalage des données dans les coordonnées de Talairach et Tournoux (1988), choix du seuil de significativité etc.).
Les travaux d’imagerie ont révélé que l’observation et l’imitation d’actions activait, outre les aires occipitales visuelles, la région du STS, le cortex pariétal, le cortex prémoteur, mais aussi, dans certains études, l’aire de Broca (Chaminade et al., 2002 ; Decéty et al., 1997, 2002 ; Grafton et al., 1996 ; Grèzes et al., 2003 ; Iacoboni et al., 1999, 2001 ; Koski et al., 2002, 2003 ; Rizzolatti et al., 1996b). Sur le versant de l’observation d’actions, Rizzolatti et collègues (1996b) ont par exemple décrit un recrutement du gyrus temporal médian, incluant le STS, et de l’aire 45 du gyrus frontal inférieur gauche. Sur le versant de l’imitation, Iacoboni et collègues (1999) ont quant à eux démontré une activation de la pars opercularis du gyrus frontal inférieur gauche (BA 44) et de la région pariétale antérieure droite à la fois lorsque des sujets imitaient des mouvements des doigts, les exécutaient en réponse à des indices spatiaux et symboliques (condition non imitative) et les observaient. Les activations étaient en outre plus soutenues dans la condition imitative que dans la condition non imitative, confirmant la sensibilité du système miroir à l’imitation des actions (Arbib, 2002, 2004 ; Nishitani & Hari, 2000, 2002). Les neurones miroir chez le singe ayant été découverts dans le cortex prémoteur ventral et le cortex pariétal inférieur, et des neurones répondant à l’observation de stimuli biologiques en mouvement ayant été décrits dans le STS simien, les résultats recueillis chez l’homme sont donc en faveur d’une homologie des aires corticales formant le système miroir chez les primates humains et non humains.
Decéty et ses collaborateurs (1997) ont par ailleurs révélé des patterns d’activation miroir différents en fonction du contenu sémantique des actions présentées (i.e. pantomimes d’actions ayant un sens, vs. actions « sans signification » dérivées du langage des signes) et de la stratégie cognitive des sujets (i.e. observation dans le but de reproduire vs. de reconnaître). Premièrement, indépendamment de la stratégie des sujets, l’observation de pantomimes d’actions activait principalement le gyrus frontal inférieur (BA 45 et 47) et le gyrus temporal médian (BA 21) de l’hémisphère gauche, tandis que l’observation d’actions sans signification recrutait les aires occipito-pariétales (BA 18, 19, 7 et 40) et prémotrice (BA 6) droites. Ces données suggèrent donc que l’aire de Broca ne semble participer qu’à la reconnaissance des actions ayant un sens et dirigées vers un but, proposition toutefois nuancée par l’activation de cette même aire lors de l’observation et de l’imitation d’actions intransitives et sans signification rapportée par Nishitani et Hari (2000). Les auteurs suggèrent également que l’activation latéralisée à gauche pour ces actions reflète l’accès à l’information sémantique associée, particulièrement lorsqu’elles sont réalisées sur un objet ; à l’inverse, les actions sans signification seraient décodées à travers leurs aspects spatiotemporels (i.e. direction des mouvements, cinématique), conduisant à une activation de la voie dorsale 4 particulièrement dans l’hémisphère droit. Deuxièmement, lorsque l’intention du sujet était d’imiter le modèle observé, indépendamment de la nature des actions, les structures impliquées dans la planification d’actions étaient activées dès la phase perceptive (cortex préfrontal dorsolatéral bilatéral et partie antérieure de l’aire motrice supplémentaire gauche ou pré-AMS). Lorsque le but de l’observation était de reconnaître les actions, le gyrus parahippocampique droit, connu pour participer aux processus d’encodage mnésique, était recruté. L’ensemble de ces résultats démontre donc que les régions cérébrales engagées dans l’observation d’actions sont, d’une part, modulées par la nature des mouvements perçus (possédant ou non une signification) et, d’autre part, dépendantes de la nature du traitement engagé (but de reproduire ou de reconnaître). Ils supportent également l’idée selon laquelle la médiation perception/action repose sur des représentations motrices qui sont activées ou construites dès la phase perceptive d’observation (Vogt, 1996, cité par les auteurs).
Le résultat le plus intéressant obtenu dans ces études d’imagerie est évidemment l’activation de l’aire de Broca, apportant une pierre supplémentaire à l’édifice « système miroir précurseur du langage ». Toutefois, cette activation a fait l’objet d’une controverse. Ainsi, bien qu’une homologie anatomique ait été proposée entre la pars opercularis de l’aire de Broca (BA44) et F5 (Petrides & Pandya, 1997 ; mais voir Petrides et al., 2005), il est classiquement admis que cette aire 44 soit l’aire motrice du discours articulé. Or, dans une méta-analyse des études réalisées en TEP, Grèzes et Decéty (2001) n’ont pas retrouvé cette activation robuste de l’aire 44 lors de l’observation d’actions, et ont donc soulevé l’idée que son activation, dans les études susmentionnées, puisse être liée à la médiation verbale de l’action observée, plutôt qu’à une résonance dans le système moteur de l’observateur. Deux types d’arguments viennent réfuter cette hypothèse. D’abord, un nombre croissant d’études suggère que l’aire 44, outre son rôle dans la production linguistique, contienne, tout comme l’aire F5 simienne, une représentation motrice de la main (Binkofski et al., 1999ab ; Decéty et al., 1994 ; Gerardin et al., 2000 ; Iacoboni et al., 1999 ; Krams et al., 1998 ; Uozumi et al., 2004). Dans une étude en IRMf, Binkofski et collègues (1999a) ont par exemple rapporté que la manipulation d’objets tridimensionnels de forme complexe (en l’absence de feedback visuel) activait, entre autres, l’aire 44 de manière bilatérale, avec une prédominance hémisphérique gauche quelle que soit la main utilisée. Par ailleurs, une comparaison des activations cérébrales lorsque les sujets manipulaient attentivement et exploraient les propriétés des objets avec pour consigne d’éviter de les dénommer implicitement ou de les nommer silencieusement a révélé une activation de l’aire 44 dans les deux conditions, mais une activation supplémentaire de l’aire 45 (pars triangularis de l’aire de Broca) dans la condition de dénomination silencieuse uniquement. Il apparaît donc que la verbalisation interne ne puisse à elle seule expliquer l’activation de l’aire 44 dans cette étude, mais que cette aire, appartenant à un circuit cortical fronto-pariétal de manipulation des objets, code une représentation de la main.
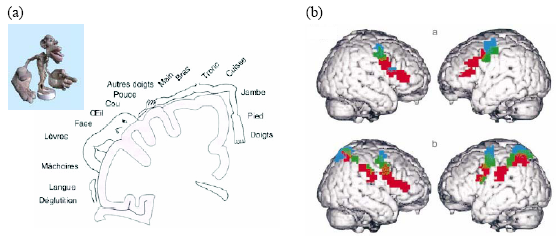
Ensuite, les études d’imagerie plus récentes ont démontré un rôle crucial de l’aire de Broca dans l’appariement entre observation et exécution des actions (Buccino et al., 2001, 2004a ; Hamzei et al., 2003 ; voir aussi Heiser et al., 2003 pour une étude en TMS). Buccino et ses collègues (2001) ont ainsi étudié, en IRMf, l’activation du système moteur lors de l’observation d’actions, transitives ou non, réalisées avec la main, la bouche ou le pied. Le but de cette étude était double : i) déterminer si le pattern d’activation motrice lors de l’observation d’actions suivait l’organisation somatotopique du cortex moteur 5 (Penfield & Rasmussen, 1952). Si les actions observées résonnent effectivement dans le répertoire moteur de l’observateur, des représentations motrices spécifiques devraient être activées lorsque ces actions sont réalisées par différentes parties du corps ; ii) décider si l’activation de l’aire de Broca résultait d’une verbalisation interne, hypothèse selon laquelle cette aire devrait être recrutée quel que soit l’effecteur utilisé. Alternativement, un rôle spécifique de l’aire de Broca dans la reconnaissance des actions effectuées par autrui devrait se traduire par son activation uniquement lors de l’observation d’actions manuelles et buccales, les aires motrices de la main et de la bouche étant localisées dans ou à proximité de cette aire. De manière intéressante, leurs résultats ont mis en évidence une activation somatotopique du cortex prémoteur bilatéral lors de l’observation des actions transitives et intransitives réalisées avec les différents effecteurs. Ainsi, l’observation de mouvements transitifs de la main activait principalement le cortex prémoteur bilatéral dont la pars opercularis du gyrus frontal inférieur (BA 44) et la partie supérieure du gyrus précentral (BA 6). Deux foyers d’activation étaient également reportés dans le lobule pariétal inférieur bilatéral (Figure 2.9.a). L’observation de mouvements transitifs de la bouche conduisait également à une activation bilatérale du cortex prémoteur (BA 6 et 44), mais aussi de l’aire 45 droite et des lobules pariétaux principalement gauches (Figure 2.9.b). Enfin, l’observation des mouvements transitifs avec le pied activait le secteur dorsal du gyrus précentral (BA 6) et le lobe pariétal postérieur bilatéral (dont une partie recouvrait les activations observées pour les mouvements de la bouche et de la main ; Figure 2.9.c). Quel que soit l’effecteur utilisé, l’observation de mouvements intransitifs suscitait les mêmes activations prémotrices mais pas pariétales. La figure 2.10.b illustre la somatotopie des activations cérébrales lors de l’observation des actions réalisées avec les différents effecteurs.
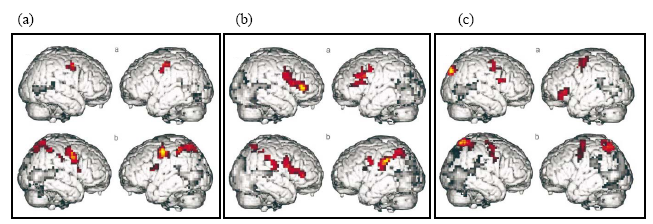
Pris de Buccino et al. (2001)
(a) Actions intransitives. (b) Actions transitives. Vert, actions de la main ; Rouge, actions de la bouche ; Bleu, actions du pied. Le recouvrement des couleurs indique les régions cérébrales activées lors de l’observation des actions réalisées avec les différents effecteurs. La partie gauche de chaque panneau représente l’hémisphère droit, et la partie droite l’hémisphère gauche. Pris de Buccino et al. (2001).
Ces résultats indiquent donc que les cartes d’activation motrice obtenues lorsque des sujets observent des actions réalisées avec différents effecteurs correspondent à la carte motrice obtenue lors de la stimulation électrique des mêmes régions corticales (Penfield & Rasmussen, 1950). En d’autres termes, l’activation prémotrice suit un gradient ventro-dorsal lorsque les effecteurs utilisés pour réaliser les actions observées passent de la bouche à la main, puis au pied. La première preuve d’une implication du système miroir humain dans la reconnaissance des actions réalisées avec la main mais aussi avec d’autres effecteurs a donc été apportée en imagerie cérébrale, suggérant l’existence d’un mécanisme de résonance observation/exécution dévolu à un répertoire très riche d’actions. Aucune activation de l’aire de Broca n’ayant été relevée durant l’observation d’actions effectuées par le pied, ces données permettent également de réfuter l’hypothèse d’une activation de cette aire due à la verbalisation interne des actions observées. La présente étude démontre donc l’existence d’un système miroir chez l’homme incluant une grande partie du cortex prémoteur mais aussi le lobe pariétal. Ce dernier est toutefois recruté uniquement lorsque les actions observées sont transitives, indiquant qu’une analyse « pragmatique » de l’action soit réalisée alors même que cette action est observée et non exécutée (Jeannerod, 1994 ; Jeannerod et al., 1995 ; Milner & Goodale, 1995).
L’une des propriétés des neurones miroir simiens est qu’ils déchargent lorsque le singe observe l’un de ses congénères réaliser une action, mais aussi lorsque cette action, si tant est qu’elle appartienne à son répertoire moteur, est effectuée par l’expérimentateur. La question qui s’est alors rapidement posée était de déterminer si le système miroir chez l’homme répondait de manière semblable à l’observation d’actions appartenant ou non à notre répertoire moteur. Cette hypothèse a été récemment testée dans deux études d’imagerie cérébrale (Buccino et al., 2004a ; Mason et al., 2004) ayant comparé les activations obtenues lors de l’observation d’actions ou du traitement verbal de mots désignant des actions réalisées par un congénère ou par un animal. Buccino et ses collègues (2004a) ont ainsi demandé à des sujets sains d’observer des actions de la bouche, réalisées par un homme, un singe ou un chien, de deux natures : transitives, communes aux trois espèces (i.e. mordre dans de la nourriture), et communicatives, spécifiques à chaque espèce (i.e. articulation silencieuse - lecture labiale pour l’observateur -, « lip-smacking » silencieux et aboiement silencieux respectivement). Les résultats dans la condition « actions transitives communes » ont révélé, quel que soit l’agent de l’action, des activations des aires visuelles occipitales bilatérales, mais aussi prémotrices (pars opercularis) et pariétales bilatérales (lobules pariétaux inférieurs ; Figure 2.11.a). En revanche, lorsque les actions observées, à valeur communicative, étaient spécifiques à chaque espèce, des patterns d’activation différents ont été mis en évidence (Figure 2.11.b). Ainsi, l’aire de Broca (pars opercularis gauche) était activée lors de la lecture labiale (en accord avec Calvert & Campbell, 2003 et Campbell et al., 2001), alors que le STS droit était principalement recruté lors de l’observation du « lip-smacking » et de l’aboiement. Les aires occipitales étaient également activées quel que soit l’espèce considérée, les activations étant les moins prononcées dans le cas de l’observation d’actions communicatives propres à l’homme.

Pris de Buccino et al., (2004a).
Ces résultats révèlent donc que l’observation d’actions communes à l’homme et à l’animal, bien que très différentes visuellement, active un même réseau d’aires corticales, tandis qu’un pattern d’activation distinct émerge lorsque les actions décrivent des comportements spécifiques à chaque espèce, alors même qu’ils partagent un but commun : communiquer. Les auteurs ont alors conclu que la reconnaissance des actions réalisées par autrui fasse appel à deux mécanismes. Pour les actions appartenant au répertoire moteur de l’observateur, qu’elles soient réalisées ou non par un congénère, un mécanisme de résonance entre la description visuelle de ces actions et leur représentation motrice dans le système moteur de l’observateur serait mis en jeu. A l’inverse, les actions externes à ce répertoire ne pourraient pas « résonner » dans le système moteur de l’observateur et seraient reconnues essentiellement par le biais d’une analyse visuelle. La démonstration d’une activation du système miroir chez le singe lors de l’observation d’actions réalisées au moyen d’outils, alors même que les singes ne sont pas capables d’exécuter ces mêmes actions (Ferrari et al., 2005), suggère donc une différence entre les mécanismes de résonance des primates humains et non humains. Pour les premiers, la résonance ne se produirait que pour les actions possédant une représentation motrice dans le répertoire moteur de l’observateur, tandis que pour les seconds, le système miroir serait activé quand bien même les actions observées ne seraient pas partie intégrante de ces représentations motrices. Mais alors, comment les actions que nous percevons mais que nous n’avons jamais appris à exécuter (e.g. tricoter, skier etc.) sont-elles reconnues ? Activent-elles également le système miroir ? Bien que cette question nécessite encore d’être examinée de manière plus précise, deux éléments de réponse peuvent être apportés.
D’abord, Buccino et ses collègues (2004b) ont décrit une activation des aires « miroir » lors de l’observation et de l’imitation d’actions que les sujets n’avaient jamais appris à réaliser. Des musiciens « naïfs » devaient ainsi observer un guitariste jouer de son instrument, et après cette période d’observation, exécuter les mêmes mouvements. De manière intéressante, leurs résultats ont démontré une activation bilatérale du « circuit miroir » lors de l’observation de ces actions non familières, incluant le lobule pariétal inférieur, le gyrus frontal inférieur postérieur et le gyrus précentral dorsal. Une activation supplémentaire du gyrus frontal médian (BA 46) ainsi que des structures de préparation motrice (AMS) était en outre obtenue lors du délai entre les phases d’observation et d’exécution, suggérant que l’imitation d’actions repose principalement sur l’interaction de l’aire 46 avec le système miroir. Ces résultats suggèrent donc que le système miroir soit impliqué dans des processus d’abstraction du but de l’action, permettant aux individus de reconnaître et d’imiter cette action, qu’ils en aient ou non une expérience motrice (Ferrari et al., 2005). Autrement dit, le système miroir coderait le but général d’une action, de sorte que nous serions capables de la comprendre, sans savoir, ou sans avoir encore appris à la réaliser.
Par la suite, Calvo-Merino et al. (2005) ont révélé un degré de correspondance entre l’action observée et les capacités motrices de l’observateur. Aussi l’activation du système miroir est-elle modulée, lors de l’observation d’actions, en fonction du degré d’expertise de l’observateur pour effectuer ces actions. Les auteurs ont demandé à des sujets experts en danse classique et en capoeira (art martial brésilien) de regarder attentivement des séquences vidéo de ballet de danse et de mouvements de capoeira alors que leur activité cérébrale était mesurée en IRMf. Leurs résultats ont révélé des activations « miroir » prémotrice et pariétale, à prédominance gauche,et du STS bilatéral, plus importantes lorsque les sujets possédaient la représentation motrice des actions observées dans leur propre répertoire moteur. Chez les danseurs, l’activité du système miroir était donc plus soutenue pour le ballet et chez les « capoeiristes » pour les mouvements de capoeira. Aucune influence du type de mouvements observés n’a été rapportée chez des sujets contrôle non experts, suggérant que les patterns observés dépendent des habiletés motrices des sujets experts et non des propriétés visuelles de ces mouvements. Mais les effets observés pourraient également résulter d’une plus grande familiarité visuelle des danseurs avec les mouvements observés plutôt que d’une résonance spécifique avec leurs représentations motrices. Deux arguments viennent réfuter cette alternative. D’une part, aucun effet lié à l’expertise n’a été retrouvé dans le gyrus fusiforme, pourtant recruté dans des tâches de familiarité visuelle et d’apprentissage perceptuel (Gauthier et al., 1999, et Tarr & Gauthier, 2000, cités par les auteurs). D’autre part, Glaser et al. (2004) ont rapporté des effets similaires alors même que la familiarité visuelle des actions avait été contrôlée. Ainsi, chez les danseurs de ballet, certains mouvements sont spécifiques au genre, alors que d’autres sont exécutés à la fois par les femmes et les hommes. En dissociant ces mouvements, les auteurs ont démontré une activation pariétale gauche moins prononcée chez les danseuses lorsqu’elles observaient des mouvements réalisés uniquement par leurs partenaires, en regard de mouvements exécutés soit par elles seules soit par les deux sexes. Le mécanisme de résonance semble donc spécifiquement adapté au répertoire moteur des individus, suggérant que l’observation d’actions implique une simulation interne de ces actions (Gallese & Goldman, 1998 ; Jeannerod, 1994).
Ces deux études, bien qu’elles doivent encore être corroborées, suggèrent donc que notre système miroir soit recruté lors de l’observation d’actions qui nous sont familières ou non en termes moteurs, la résonance étant toutefois plus forte pour les actions possédant déjà une représentation dans notre répertoire moteur.
L’ensemble des études d’imagerie cérébrale révèle donc que le système miroir humain est recruté en réponse à l’observation et à l’imitation d’actions transitives et intransitives, mais les données restent confuses quant à sa latéralisation. Certains auteurs ont en effet décrit des patterns d’activation corticale sensiblement latéralisés dans l’hémisphère gauche, alors que d’autres, plus nombreux, ont rapporté des activations bilatérales. Aussi est-il surprenant de constater que les auteurs se soient, jusqu’à très récemment, peu intéressés à cette question. La démonstration d’une correspondance entre la latéralisation du langage et celle du système miroir permettrait pourtant d’accréditer, ou au contraire de réviser, l’hypothèse du système miroir comme germe du langage (Rizzolatti & Arbib, 1998).