X.1.1. La maladie de Parkinson
La maladie de Parkinson idiopathique, portant le nom de James Parkinson qui en fit une première description en 1817 sous le nom de « paralysie trépidante » (cité dans Charcot, 1860), est une affection dégénérative du système nerveux central, apparaissant généralement après 50 ans, sans distinction apparente de sexe (certains rapportent toutefois une fréquence discrètement plus élevée chez les hommes). Elle est la quatrième pathologie dégénérative la plus fréquente chez les personnes âgées. On estime aujourd’hui à 4 millions le nombre de personnes affectées dans le monde, dont environ 100 000 personnes en France, avec 8000 nouveaux cas chaque année. Sa prévalence en Europe est estimée à 150 à 200 pour 100 000 habitants soit 1.5 à 2 % de la population âgée de plus de 65 ans. Comme beaucoup d'autres troubles neurologiques, la maladie de Parkinson est chronique, évolutive et pour le moment incurable. Elle est d'étiologie inconnue. Caractérisée par une association de signes neurologiques, son expression est en fait très diverse. Les traitements ont bouleversé le pronostic vital, mais la maladie reste souvent responsable d'une invalidité importante, même si son évolution est très variable.
Anatomie et mécanismes mis en jeu
La maladie de Parkinson est caractérisée principalement par la destruction sélective des neurones dopaminergiques (i.e. producteurs du neurotransmetteur dopamine) d’une structure sous-corticale bien localisée, associée aux ganglions de la base, la substance noire compacte (ou substantia nigra pars compacta ; Figure 10.1).
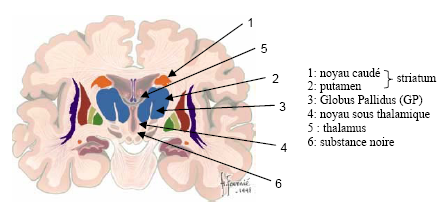
Les ganglions de la base sont des structures très volumineuses situées au niveau du télencéphale. Ils sont formés d’un ensemble de structures nerveuses dont les principales sont : le noyau caudé (1) et le putamen (2) (regroupés sous le terme de striatum), le Globus Pallidus (3, parties interne et externe ; encore appelé pallidum) et le noyau sous-thalamique (4). De façon générale, bien que cette structure ne fasse pas strictement partie des ganglions de la base, la substance noire (6) est associée à ces noyaux ; il s’agit d’une structure mésencéphalique majeure connectée avec les ganglions de la base, divisée en pars compacta et pars reticulata.
Les ganglions de la base jouent un rôle indirect, bien que crucial, dans le contrôle moteur, et notamment dans la préparation motrice (Alexander et al., 1986 ; DeLong, 1990). Ainsi, ils reçoivent des informations en provenance de larges zones du cortex cérébral, et notamment du cortex moteur primaire (M1), des aires prémotrices latérales (PM), de l’aire motrice supplémentaire (AMS) et du cortex pariétal. Ces informations sont ensuite traitées au niveau d’une boucle motrice « cortico-striato-thalamo-corticale », impliquant le thalamus et un retour vers le cortex, particulièrement au niveau de l’AMS (Figure 10.2). L’une des fonctions de cette boucle est vraisemblablement de sélectionner et de déclencher les mouvements volontaires : en se projetant, de manière indirecte, sur M1, le PM et l’AMS, les ganglions de la base contribuent à faciliter le déclenchement des mouvements (Williams et al., 2002).
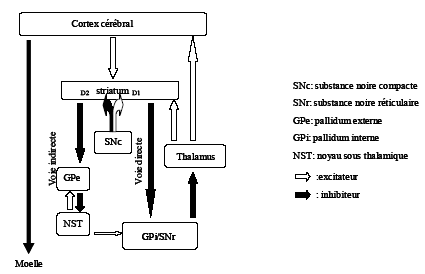
La boucle prend son origine principalement au niveau des cortex moteur et prémoteur et implique une connexion de type excitateur avec les cellules du striatum. Les cellules striatales font synapse avec les neurones du Globus Pallidus interne et externe (GPi et GPe) selon deux voies (directe et indirecte) : ces connexions sont inhibitrices. A leur tour, les cellules du GPi (et de la substance noire reticulata, SNr) se projettent sur le noyau ventro-latéral du thalamus (VL) ; cette projection neuronale est également inhibitrice. La projection thalamo-corticale (de VL à l’AMS), excitatrice, facilite la décharge des neurones de l’AMS liés au mouvement. La conséquence de l’activation du striatum par le cortex cérébral est donc, en retour, une activation des cellules de l’AMS au travers du VL. Parallèlement, la substance noire compacta (SNc) module l’activité du striatum via des projections dopaminergiques excitatrices de la voie directe (D1) et inhibitrices de la voie indirecte (D2). Au repos, les neurones du GP sont spontanément actifs et exercent une inhibition (frein moteur) sur le thalamus. L’activation corticale lors d’un mouvement (1) excite les neurones du putamen, (2) qui inhibent les neurones du GPi via la voie directe ; (3) les cellules du VL sont alors libérées de leur inhibition pallidale et activées. L’activation du VL a enfin pour effet de faciliter l’activité de l’AMS. Cette facilitation, ou levée du frein moteur du GPi, est renforcée par la SNc via son action sur le striatum : d’une part, les connexions D1 stimulent la voie directe, d’autre part, les connexions D2 inhibent la voie indirecte (conduisant à une inhibition du NST qui n’active plus le GPi). Cette partie du circuit agit comme une boucle de rétroaction positive. Elle permet la focalisation des informations issues de larges régions corticales sur l’AMS principalement.
Dans la maladie de Parkinson, la dégénérescence de la voie neuronale reliant la substance noire au striatum, qui utilise la dopamine comme neuromédiateur, se traduit par un dysfonctionnement de la boucle frontale motrice (Figure 10.3). Chez le sujet sain, la dopamine exerce en effet un rôle facilitateur sur cette boucle via une action directe sur les neurones du putamen. La déplétion en dopamine chez les patients parkinsoniens entraîne donc un blocage du système d’activation de l’AMS et du cortex prémoteur par les ganglions de la base et le thalamus, conduisant à des troubles de déclenchement des mouvements volontaires. En d’autres termes, le déficit en dopamine chez les patients se traduit par un frein moteur excessif (GPi anormalement activé) sur les cortex prémoteur et moteur. Les études d’imagerie cérébrale menées chez les patients parkinsoniens ont d’ailleurs révélé, lors de la réalisation de tâches motrices simples (i.e. déclenchement de mouvements), une hypoactivation des régions de préparation motrice recevant des afférences fortes issues des ganglions de la base (AMS notamment ; Jahanshahi et al., 1995 ; Jenkins et al., 1992 ; Playford et al., 1992 ; Rascol et al., 1992, 1994 ; Sabatini et al., 2000). Cette hypoactivation était normalisée par l’administration d’un traitement dopaminergique, preuve de l’importance de la stimulation dopaminergique dans le recrutement des aires corticales prémotrices (Jenkins et al, 1992). A l’inverse, les cortex sensorimoteur primaire, prémoteur latéral et pariétal apparaissaient normalement, voire plus fortement, activés chez les patients. Une autre étude plus récente (Turner et al., 2003) a toutefois révélé que les patterns anormaux d’activation cérébrale dépendaient de la tâche utilisée (voir aussi Catalan et al., 1999). Ainsi, lors de la poursuite plus ou moins rapide de cibles avec la main, censée évaluer la bradykinésie des patients (i.e. lenteur des mouvements), Turner et al. (2003) ont d’une part décrit une hypoactivation, liée à l’exécution motrice proprement dite, du cortex sensorimoteur primaire, du cortex prémoteur bilatéral, des ganglions de la base et du cervelet chez des patients privés de traitement dopaminergique, en regard de sujets sains. D’autre part, l’analyse des activations sélectivement liées à la vitesse du mouvement a révélé une hyperactivation de ces mêmes régions chez les patients (aires sensorimotrices bilatérales, cortex prémoteur ventral et dorsal, AMS et ganglions de la base), alors que cet effet n’était pas observé chez les sujets témoins. Autrement dit, suite à la déplétion dopaminergique, les aires prémotrices et motrices apparaissent plus faiblement activées lors de l’exécution de mouvements, alors qu’elles sont hyperactivées à mesure que la vitesse du mouvement augmente. Les auteurs ont interprété cette hyperactivation en termes de mécanismes de compensation et/ou de traits spécifiques à la maladie de Parkinson.
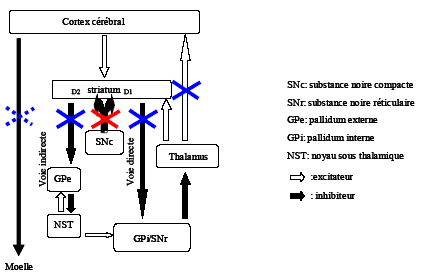
Lors de l’élaboration d’un mouvement,la destruction des neurones dopaminergiques liant la SNc au striatum se traduit par (1) une inhibition insuffisante, via la voie directe, du GPi qui peut alors exercer pleinement son frein moteur sur le thalamus, (2) une levée d’inhibition de la voie indirecte, se traduisant par inhibition du GPe, qui ne peut plus inhiber le noyau sous-thalamique (NST). Celui-ci renforce alors son action excitatrice sur le GPi. Au final, chez le patient parkinsonien, le thalamus, fortement inhibé par le GPi, ne peut plus exercer son influence excitatrice sur le cortex, et notamment sur l’AMS, conduisant à des troubles moteurs.
Outre la boucle motrice, d’autres boucles fronto-sous-cortico-frontales impliquant les ganglions de la base ont été décrites (Alexander et al., 1986 ; Alexander & Crutcher, 1990ab ; Parent, 1990). Ces boucles, au nombre de cinq selon Alexander et collègues, fonctionnent en parallèle et assurent chacune des activités cognitives différentes. Elles engagent des régions spécifiques du cortex, des ganglions de la base (striatum, pallidum et substance noire) et du thalamus. La boucle oculomotrice prendrait naissance dans le « Frontal Eye Field » (FEF, BA 8) et le cortex pariétal postérieur, et se projetterait sur le corps central du noyau caudé. La boucle préfrontale dorsolatérale (BA 46) emprunterait quant à elle la région dorsolatérale des noyaux caudés dont l’intégrité est nécessaire aux fonctions exécutives. Un circuit orbitofrontal, impliqué dans l’adaptation du comportement (intégration des informations viscérales et amygdaliennes sur l’état interne de l’organisme, ainsi que des informations limbiques et émotionnelles), se projetterait sur les parties ventrales des noyaux caudés. Les boucles préfrontale dorsolatérale et orbitofrontale sont également regroupées sous le terme de « boucles associatives ». Enfin, la « boucle limbique », émanant du cortex cingulaire antérieur, activerait principalement le noyau accumbens (striatum ventral) essentiel aux fonctions motivationnelles (Figure 10.4).
Les ganglions de la base se situent donc au carrefour des informations en provenance de diverses régions du cortex. En ce sens, ils constituent une interface fondamentale jouant un rôle d’intégration et de couplage des boucles motrices, associatives et limbique. Ils facilitent notamment le déroulement des plans moteurs et de la pensée (habitude, fluidité), inhibent les mouvements anormaux et les interférences de la pensée (concentration, nouveauté) ou encore modulent l’interaction entre la motivation, l’affect, le stress et le mouvement ou la pensée.
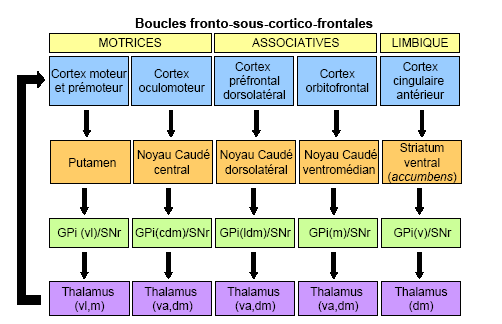
cdm, dorsomédian caudal ; dm, dorsomédian ; ldm, dorsomédian latéral ; m, médian ; v, ventral ; va, ventro-antérieur ; vl, ventro-latéral.
- Tableau clinique
La maladie de Parkinson se manifeste généralement par une triade de signes dits cardinaux, regroupés sous le terme de syndrome parkinsonien : -
- un tremblement des membres au repos : il est distal, souvent inaugural, intermittent et unilatéral au début. C'est un symptôme qui disparaît lors des mouvements volontaires et du maintien de la posture. L'émotion et la concentration l'augmentent. Il est régulier, au rythme de 4 à 6 cycles par seconde. Il prédomine sur la main mais atteint aussi les membres inférieurs et exceptionnellement le menton.
- une akinésie et une bradykinésie : l’akinésie est un retard dans le déclenchement du mouvement volontaire et la bradykinésie est la lenteur du geste. Le sujet est comme ralenti, économe de ses mouvements. Cela se traduit par une micrographie (i.e. écriture très petite et quasi-illisible), une lenteur de certains gestes de la vie courante (e.g. se raser, boutonner sa chemise etc.) et un visage inexpressif, figé, avec rareté du clignement. Il y a en outre perte des mouvements automatiques, tels que le balancement du bras lors de la marche.
- une rigidité musculaire ou hypertonie : elle se traduit par des douleurs cervicales, lombaires ou des membres supérieurs, mais aussi par :
-
- une marche perturbée quand l’atteinte devient bilatérale. C’est une marche lente, à petits pas. Le démarrage est parfois difficile avec piétinement sur place (« enrayage cinétique »). On constate également des troubles de l’équilibre souvent à l’origine de chutes.
- une atteinte, assez tardive, de la posture avec attitude générale en flexion : tête penchée en avant, dos courbé, genoux et coudes demi-fléchis.
- l’acathisie, besoin impérieux de se lever et de marcher, fréquemment constatée lors de l’évolution de la pathologie.
Les troubles moteurs peuvent également concerner l’élocution, on parle alors de dysarthrie, définie par une parole lente, assourdie et monotone.
Si la maladie de Parkinson est fréquemment décrite sur le plan des troubles moteurs qui l’accompagnent, elle ne se limite pas à ces manifestations. Dès 1882, Ball rapportait en effet des cas de démence et d’hallucinations chez les patients parkinsoniens. Ces troubles cognitifs, bien que longtemps ignorés au profit des symptômes moteurs, font depuis quelques années l’objet d’un nombre croissant de travaux (pour une revue, voir Pillon et al., 2001, et Bosboom et al., 2004). Le niveau de gravité du déclin cognitif, présent dès les stades précoces de la maladie, est variable, allant des troubles attentionnels sans retentissement sur la vie quotidienne à la démence, totalement invalidante. Ces troubles cognitifs résulteraient d’une atteinte des boucles frontales associatives et limbique suite à la déplétion dopaminergique. Les déficits les plus fréquemment rapportés sont ceux atteignant les fonctions exécutives 17 (Cooper et al., 1991 ; Dubois & Pillon, 1997 ; Levin & Katzen, 2005 ; Owen et al., 1992 ; Uc et al., 2005), les performances étant parfois comparables à celles des patients porteurs de lésions frontales. Aussi les patients parkinsoniens éprouvent-ils des difficultés à élaborer un plan d’action, à maintenir un programme d’action tout en résistant aux interférences potentielles, ou encore à adapter leur comportement aux changements extérieurs (moindre flexibilité mentale). L’on constate également des troubles de l’attention sélective (Malapani et al., 1994) et de la mémoire, en particulier de la mémoire de travail (Cooper et al., 1991, 1993 ; Owen et al., 1997 ; Pillon et al., 1996), ces altérations mnésiques étant d’autant plus importantes que la maladie évolue, et plus marquées pour le matériel visuel que verbal. En outre, des déficits d’apprentissage procédural (Cooper et al., 1991 ; Sarazin et al., 2002) et de traitement visuo-spatial ont été mis en évidence (Diederich et al., 2002 ; Uc et al., 2005). D’autres auteurs rapportent également des troubles de reconnaissance des expressions faciales (Dujardin et al., 2004 ; Lachenal-Chevallet et al., 2006 ; Suzuki et al., 2006) ou encore de la cognition sociale (i.e. prise de décision, théorie de l’esprit etc. ; Yoshimura & Kawamura, 2005). Les troubles apraxiques et linguistiques sont plus rares. Enfin, la prévalence de la dépression et de la démence dans la maladie de Parkinson est élevée (supérieure à la population moyenne), puisqu’elles se déclarent chez 30 % et 15 à 20 % des patients respectivement. Le début tardif et la sévérité de la maladie ainsi que la présence de troubles mnésiques et dysexécutifs semblent notamment induire un risque plus important de démence (Ebmeier et al., 1990 ; Hughes et al., 2000 ; Levy et al., 2002). Les stades avancés de la maladie peuvent aussi être caractérisés par des hallucinations ou une confusion mentale.
Trois étapes évolutives sont classiquement décrites en fonction de l’efficacité du traitement dopaminergique sur les symptômes moteurs dans la maladie de Parkinson :
- la « lune de miel », période variant de 3 à 8 ans, qui se définit par une vie pratiquement normale. C'est une période de meilleure efficacité du traitement dopaminergique.
- les classiques fluctuations qui affectent 60 % des patients après 6 ans d’évolution : akinésie et dyskinésies (i.e. mouvements anormaux involontaires).
- la troisième période, la plus handicapante, correspond à la perte d’efficacité du traitement.
La maladie de Parkinson étant encore incurable, le traitement médical a pour principal objectif de corriger les symptômes, en particulier moteurs, afin d’atténuer leurs conséquences sur la vie personnelle et sociale du patient et d’augmenter son espérance de vie. A l’heure actuelle, la L-Dopa, précurseur de la dopamine, reste la pierre angulaire de la prise en charge des patients et le meilleur des « antiparkinsoniens ». Elle a en effet largement fait la preuve de son efficacité à long terme sur la triade symptomatique de la pathologie, et on estime qu’elle permet d’allonger l’espérance de vie des patients d’au moins 5 ans. Cependant, des complications motrices « dopa-induites », souvent sévères, telles que des fluctuations motrices (effets On/Off de déblocage/blocage) et des dyskinésies, apparaissent dans 86 % des cas après la période de « lune de miel ». Ces complications entraînent à long terme un handicap fonctionnel pour le patient qui perd peu à peu le bénéfice initial procuré par le traitement. La chirurgie (chirurgie lésionnelle ou stimulation cérébrale profonde) peut alors proposer une alternative thérapeutique aux patients pour lesquels le traitement médical dopaminergique ne permet plus de contrôler les signes moteurs et leurs fluctuations. Ainsi, la stimulation cérébrale profonde, apparue à la fin des années 80, consiste à implanter une électrode dans des noyaux cibles du cerveau, tels que le noyau sous-thalamique, le Globus Pallidus interne et le noyau ventral intermédiaire thalamique, afin d’interférer, par des impulsions électriques de haute fréquence, avec les séquences de signaux électriques anormaux. Bien que présentant des intérêts certains, cette technique émergente reste toutefois lourde, délicate et coûteuse, ce qui en limite l’accès à un grand nombre de patients en échec thérapeutique. En outre, ses indications précises sont encore discutées, et son efficacité et sa tolérance chez les patients restent toujours à évaluer clairement.