Description de la séquence
L’originalité de cette séquence d’enseignement concerne sa mise en œuvre et le travail de réflexion qui l’accompagne.
L’élève trouve sur sa paillasse des échantillons métalliques et la question suivante est posée.
1) Comment peut-on reconnaître simplement le cuivre d’autres métaux comme le fer ou le plomb ?
Cette question exploite la connaissance initiale de l’élève (flèche supérieure figure 1). Elle prépare la reconnaissance du cuivre au point 5 ci-dessous. 96 des 98 comptes rendus ont proposé de reconnaître le cuivre à sa couleur dont 13 binômes répondaient en plus de la couleur l’une des caractéristiques suivantes : texture, masse, poids, forme, composition et souplesse. Les élèves se sont donc appropriés une première notion en relation avec le concept cible. En plus ils évoquent presque tous la couleur, ce qui permet de reconnaître le métal cuivre au moment où il réapparaîtra. Puis il lui est demandé de réaliser la réaction suivante :
2) Transformation n° 1 : Prendre un petit morceau de cuivre (30 à 40 mg) et l’introduire dans un tube à essai. Ajouter avec précaution environ 1 mL d’acide nitrique (port de lunettes obligatoire, éviter tout contact entre l’acide et la peau). Observer et décrire les observations.
A quoi peut-on dire que la transformation est terminée ?
Cette transformation se retrouve dans la quasi-totalité des manuels français consultés (pratiquement tous ceux édités entre 1993 et 2004). Sa pérennité provient des caractéristiques reconnaissables du métal (orangé) et des ions (bleus) qui résultent de son oxydation. A propos de la même transformation, Laugier et Dumon (2003) indiquent que les élèves constatent la disparition du cuivre, la formation d’un gaz roux (NO2, toxique), l’apparition d’une couleur bleue (Cu(H2O)6 2+) et l’échauffement de la solution (exothermicité). Avec nos conditions expérimentales, le dégagement du gaz est faible (pour que chaque binôme réalise la réaction en toute sécurité), il est donc mal perçu par les élèves si leur attention n’est pas attirée sur ce point par l’enseignant. Certains élèves pensent même que le tube à essais se colore, et il faut les aider pour leur permettre de prendre conscience qu’il s’agit de l’apparition d’un gaz. Qu’un gaz puisse être un réactif ou un produit, et même que ce soit de la matière, peuvent en effet être ignorés d’élèves de lycée (Hesse & Anderson, 1992). D’autre part, il n’y a pas d’échauffement, ce qui constitue une observable en moins. En revanche, le cuivre disparaît totalement en quelques minutes (si la concentration de l’acide est 6 à 7 mol.L–1), ce qui est essentiel pour la suite du travail qui utilise sa réapparition.
Nous constatons que notre texte ne pose de questions que sur les observations et non sur leurs interprétations. Nous faisons en effet l’hypothèse que l’élève n’est pas en mesure de proposer une interprétation puisqu’il a besoin, pour ce faire, de disposer des connaissances qui sont l’objet de l’apprentissage sur l’élément chimique qui va suivre. La question se pose donc de savoir s’il est possible d’observer sans une base théorique (Johsua & Johsua, 1987). La « théorie » derrière cette observation est la relation entre une espèce chimique ou un ion, et sa couleur ou son état physique. Cette base théorique étant connue de l’enseignant, celui-ci guide l’élève en lui demandant d’observer et, par contrat, attend une réponse sur l’évolution des couleurs.
3) Pendant que la transformation chimique se déroule, déposer avec une pipette une goutte d’acide nitrique sur la partie brillante d’une lame de fer. Rincer la lame de fer à l’eau du robinet. Décrire les observations.
Les lames de fer doivent être exemptes de rouille qui peut faire office de distracteur, par sa couleur voisine de celle du cuivre. Par ailleurs, faire constater aux élèves l’effet de l’acide nitrique sur le fer est important pour que l’interprétation des expériences à venir soit simplifiée.
4) Transformation n° 2 : Quand la transformation chimique mettant en jeu le cuivre et l’acide nitrique est terminée, ajouter 1 à 2 mL d’eau dans le tube. Boucher et agiter. Avec une pipette, prélever un peu de la solution bleue et en déposer une goutte au milieu de la partie brillante de la lame de fer. Rincer la lame de fer à l’eau du robinet. Identifier la tache observée.
Le dépôt de cuivre immédiat est identifié : “ c’est couleur cuivre ”. La notion d’expérience témoin comme la transformation n° 2 n’est pas complètement évidente6 puisque 4 binômes sur 98 ont « vu » de la rouille.
5) Les “ Blicks ” 7 sont des êtres imaginaires : admettons que l’on en a enfermé 5 dans une boîte ; voir le schéma ci-dessous. On observe la boîte le matin et le soir.

Cette 5e question met l’élève face à la source de l’analogie. C’est la première étape d’un tel fonctionnement (Sander, 1998, p.27). L’attention de l’élève est attirée sur ce qui est essentiel, une transformation dans laquelle certaines « choses » se conservent et d’autres non. Ces idées sont à la base de la construction de la catégorie « Élément chimique », voir Figure 1, et permettront d’interpréter la transformation chimique en s’appuyant sur l’analogie.
L’analogie Blicks (matin) → Blicks (soir) correspond par exemple à une réaction d’isomérisation (ex. cis-but-2-ène → trans-but-2-ène), ou à une réaction électrochimique (Cu(s) → Cu2+(aq) + 2 e–). En même temps, la représentation des Blicks oriente vers l’idée que les noyaux des atomes se conservent lors d’une transformation chimique. Une limite de cette analogie est l’absence de prise en compte de la notion de stœchiométrie, mais celle-ci n’est objet d’apprentissage que plusieurs mois après dans la séquence d’enseignement adoptée.
La forme et la disposition des Blicks ont été considérées par 85 des 98 comptes rendus comme « ne se conservant pas » dans la transformation impliquant les Blicks. A la question 5b, 46 des 98 comptes rendus indiquent que le noyau et le nombre des Blicks étaient conservés pendant cette transformation, et 52 écrivent que l’une ou l’autre de ces caractéristiques se conserve, en plus d’autres comme structure, taille... Cela indique également que la notion de conservation (et de non conservation) émerge explicitement pour le cuivre.
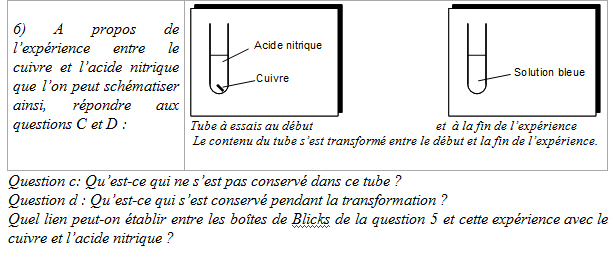
Il s’agit maintenant d’aborder le cœur de l’apprentissage de l’élément chimique. Nous attendons pour la question C : « le cuivre a disparu, la solution s’est colorée, les vapeurs rousses sont apparues », et pour la question D que « le cuivre est toujours présent dans la solution bleue, puisqu’il peut “réapparaître” ». Comment est-ce possible que le cuivre puisse disparaître tout en restant présent ?
87 des 98 comptes rendus indiquent que le cuivre ne se conserve pas, et à la question 6d, 42 indiquent que le cuivre se conserve (d’autres ont écrit que l’acide, ou la solution, se conserve). Cela renforce l’idée résultant de l’analyse de la question précédente sur l’importance du rôle des notions de conservation et de non conservation. Ce qui a constitué un trait de structure de l’analogie est, comme l’hypothèse l’avait pressentie, devenu le cœur du problème sur lequel les élèves vont réfléchir. La valeur 42/98 montre la difficulté à faire énoncer l’idée de conservation de quelque chose en rapport avec le métal cuivre, suite à sa réapparition. Cette idée semblait pourtant évidente pour les auteurs cités ci-dessus qui, depuis Viovy (1984), utilisent cet artifice expérimental.
Alors que les autres questions ont permis de mettre en jeu l’essentiel des connaissances importantes de l’activité, seuls 33 comptes rendus font apparaître simultanément que le cuivre s’est et ne s’est pas conservé. Il ne faut cependant pas en déduire que les autres binômes n’ont pas eu ce débat, les comptes rendus ne reflétant pas la totalité des idées échangées entre les élèves.
Le rôle de l’expérience en relation avec la situation analogue des Blicks a été déterminant puisqu’il a permis au moins à la moitié des élèves de prendre simultanément en compte la non-conservation et la conservation du cuivre. Savoir si les Blicks ont été importants pour les élèves est discutée avec la question 6d : dans les comptes rendus ; dans les enregistrements ; et à la dernière question lorsque l’on demande aux élèves de produire des représentations inspirées des Blicks pour traduire d’autres cycles impliquant l’élément chimique cuivre.
Les comptes rendus de la question 6d : Quel lien peut-on établir entre les boîtes de Blicks de la question 5 et cette expérience avec le cuivre et l’acide nitrique font apparaître 72 fois sur 98 (72%) l’idée était : « Comme les Blicks, le cuivre a changé de forme / d’aspect ». Pour 12 autres comptes rendus, on a trouvé « Le même fonctionnement [pour le cuivre que pour les Blicks] ». La relation attendue apparaît donc largement et de façon correcte puisque seuls 14 binômes sur 98 (14%) ne font pas de relation avec les Blicks. Il est possible d’en savoir plus en lisant la transcription des enregistrements vidéo (tableau 2) :

L’analogie de la transformation chimique, pour simple qu’elle soit, a donc effectivement joué son rôle comme les tours de parole 229, 245 et 249 le montrent. En effet, les Blicks et les éléments de la situation expérimentale sont simultanément utilisés, et les Blicks donnent du sens à la réaction chimique. Cet extrait est bien représentatif des comptes rendus comme le pourcentage élevé de mise en relation le montre. Lors de la discussion, une interprétation de termes comme « liquide » ou « fusionne » aux tours de paroles 229 et 245 sera proposée.
A l’issue de ce travail, les enseignants interrompent l’activité expérimentale pour introduire la notion d’élément chimique, y compris sa notation symbolique (par exemple Cu pour le cuivre). Celle-ci peut donc être utilisée dans la suite du travail.
Le second binôme enregistré a également donné du sens à la représentation des Blicks. L’association entre les Blicks « bien cristallisés » et le cuivre solide (compact) est faite, puis avec le cuivre qu’ils disent liquide, c’est-à-dire en solution (dispersé). Les situations analogues ont réellement été reliées, et nous avons entendu (tableau 3) :

Nous montrons ici que la contradiction s’installe effectivement et nous examinons la façon dont les élèves s’en échappent. Rappelons que la gestion de la polysémie du terme « cuivre », à l’origine de la contradiction, nous parait capitale pour comprendre la notion d’élément chimique au sens strict.
La contradiction conservation / non-conservation du cuivre est clairement apparue dans le débat d’un des deux binômes filmés (Tableau 4, tours de parole 199 : « le cuivre a disparu », et 203 : « le cuivre s’est conservé »), ce qui montre que l’analogie et l’expérience ont joué leur rôle respectif. Il en est ainsi d’une analogie, de permettre l’attribution de la propriété de conservation des Blicks à la conservation du « cuivre ». Quant à l’expérience, elle a clairement montré que le « cuivre » (le copeau métallique) ne se conservait pas lors de la transformation chimique. Cette difficulté mentionnée par Soloonidou et Stavridou (2000) est donc prise en compte.
Les élèves ont cherché à lever leur contradiction, ce qui est apparu au tour de parole 203 « [le cuivre] s’est conservé mais liquide ». L’intérêt d’une telle distinction entre le « morceau de cuivre » et le « cuivre conservé mais liquide », tient au fait que le terme « cuivre » jusqu’à présent utilisé, a donné naissance à deux notions (le morceau qui ne se conserve pas, et autre chose qui se conserve). L’enseignant introduira également deux notions : « le cuivre métal » et « l’élément chimique cuivre ». Un tel binôme d’élèves sera donc particulièrement apte à écouter ce message susceptible d’occasionner un changement conceptuel.
En favorisant la distinction de deux concepts, l’analogie a permis aux élèves d’adapter leur point de vue sur la situation expérimentale au point de vue théorique qui distingue métal et élément chimique. Par là, l’analogie estompe une difficulté centrale de l’activité de modélisation qui provient du fait que la structure des connaissances sur le champ expérimental n’est pas isomorphe à celle sur le niveau théorique. Cette adaptation des deux niveaux de connaissance, délicate pour les élèves, est advenue avec la sortie de la contradiction qui se traduit par la distinction des deux sens du mot « cuivre ».

Un tel débat est également apparu avec l’autre binôme filmé, mais la contradiction est moins explicitée. Dans les deux cas, cette discussion a été assez longue (105 et 61 tours de paroles respectivement). Pour autant, 87 des 98 comptes rendus indiquent que le cuivre a disparu alors que seulement 42 comptes rendus font apparaître que le cuivre s’est conservé.
Ces résultats montrent que la séquence d’enseignement peut soulever une contradiction. Nous avons fait l’hypothèse que celle-ci était indispensable pour que la polysémie du terme « cuivre » puisse être traitée par l’enseignant lors du bilan. Bien avant celui-ci, dans le feu de l’action, certains élèves (au moins ceux observés en vidéo) sont sortis de la contradiction en faisant émerger deux notions distinctes autour du terme « cuivre ». C’est un pas important dans l’apprentissage de la notion d’élément chimique.
Suivant les enseignants, la suite du TP a pris différentes formes. Le plus souvent, la notion d’élément chimique, en termes de conservation et de son symbole ,une fois introduite est réutilisée dans des réactions de précipitation d’hydroxyde de cuivre et de formation d’amminocomplexe. A chaque fois, la solution bleue pâle est restituée par acidification. De nouveaux petits cycles peuvent être soumis à la sagacité des élèves.
La suite du travail propose une série d’expériences pour généraliser la conservation de l’élément chimique cuivre à d’autres transformations et pour faire intervenir le transfert de l’analogie, mais cette fois en relation avec les symboles chimiques.
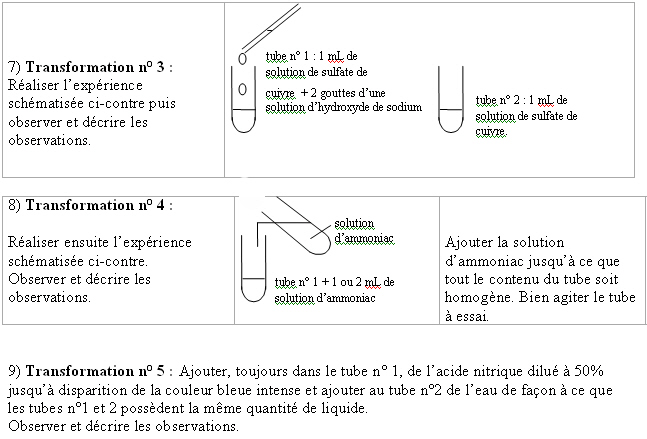
Cette partie, pour laquelle nous n’avons conservé que les travaux réalisés en autonomie, et non ceux remplis sous la direction de l’enseignant, est étudiée par l’intermédiaire de 31 comptes rendus. Elle consiste en quelques expériences en tubes à essais. La solution bleue contenant des ions Cu2+ est mise en milieu basique pour former le précipité Cu(OH)2 puis redissous en milieu ammoniacal pour former l’ion Cu(NH3)42+. Enfin, un ajout d’acide nitrique permet de faire réapparaître la couleur bleue caractéristique des ions Cu2+.
L’interprétation de ce cycle, un peu plus long que le précédant puisqu’il met en jeu trois réactions et non deux, a été proposée (tableau 5). Celui-ci associe l’ensemble des manipulations expérimentales de la séance et les couleurs observées (bleu pâle, orangé, bleu céleste). Il met également en évidence la variété des formes (en solution ou solide ; ion, précipité ou métal) sous laquelle l’élément chimique est impliqué, alors même qu’il se conserve. Les différents états physiques ont été fournis aux élèves car ceux-ci ne connaissent pas l’état « en solution » pour un ion. Dans ces conditions, le tableau fut correctement rempli dans 100% des comptes rendus, soit en rappelant le mode opératoire utilisé, soit en indiquant seulement le réactif impliqué dans la transformation, voire le numéro de la transformation.
Le remplissage du tableau par les élèves implique qu’ils ont fait des liens entre les expériences réalisées, leur description et la nature des « objets » (métal, ions) impliqués dans les transformations. Cela constitue un indice que ces connaissances de diverses natures font sens pour les élèves.

Une fois le tableau rempli, les élèves devaient réutiliser l’analogie des Blicks pour décrire ces nouvelles transformations
et répondre à la question : « De même que les boîtes de Blicks illustrent l’une des transformations chimiques de la question B , proposer, toujours à l’aide de Blicks, une illustration des transformations chimiques de la question C . » Les 31 comptes rendus font effectivement apparaître des représentations de type Blicks (annexe 8 document 8 b). Nous avons cherché à savoir si l’utilisation que les élèves en font laisse apparaître la relation avec la réaction chimique, et la conservation / non-conservation de certains critères propres aux transformations chimiques. Nous avons considéré que la relation avec les réactions chimiques était effective (23 sur 31 comptes rendus voir annexe) soit quand les élèves ont mis sur le même schéma des Blicks et des symboles chimiques (20 sur 31 ; voir Figure 4), soit s’ils ont réutilisé la numérotation des réactions chimiques (8 sur 31 ; voir figure 5). Certains ont les deux critères.

Les critères de conservation, notion essentielle, touchent à la quantité de Blicks utilisée, et au fait que, s’ils ont un noyau dans une représentation, tous doivent l’avoir. Nous avons observé que 25 des 31 comptes rendus conservent le même nombre de Blicks et 30 conservent le noyau. Les raisons pour lesquelles les élèves n’ont pas respecté la conservation du nombre de Blicks sont variées. Le non respect ‘simple’ est exceptionnel (Fig.5). En revanche, la non-conservation intervient notamment quand l’élève a cherché à étendre l’analogie à d’autres éléments chimiques que le cuivre (Fig.6). Cela peut être mis en relation avec l’absence de généralisation à d’autres éléments chimiques à ce stade de l’enseignement.
L’utilisation de l’analogie permet donc de comprendre l’essentiel de la notion de conservation même si sa mise en forme n’est pas générale dans les cas difficiles. Elle montre la limite de l’utilisation des Blicks, à savoir que si plusieurs éléments chimiques peuvent être simultanément représentés avec leur caractère conservatif sur un même schéma, ceux appartenant au solvant (H et O) peuvent ne pas l’être. Bien que cette limite de l’analogie apparaisse dans les productions des élèves, nous n’avons vu aucun des enseignants la reprendre en classe entière.


La représentation d’une transformation doit nécessairement faire apparaître certaines non-conservations, comme la représentation du changement d’état physique dû à la formation ou à la redissolution d’un précipité dans les exemples qui nous concernent. Nous nous sommes posé la question de savoir si la dispersion des ions en solution, comparée à la phase condensée que représente le précipité, a été prise en compte par les élèves dans l’analogie des Blicks. Nous avons constaté que 30 des 31 comptes rendus (97%) ont proposé des modifications d’espacements, et que 26 d’entre eux (84%) ont modifié la forme des Blicks. Parmi ceux-là, 17 (51%) ont fait correspondre l’état condensé du précipité avec des Blicks au contact, et l’état en solution avec des Blicks dispersés (Figure.4), comme s’ils avaient décodé d’eux-mêmes cette correspondance sur l’analogie donnée dans le TP. Les quelques éléments, sur le modèle particulaire de la matière, enseignés au collège, en particulier sur les solides et les liquides, ont dû être activés lors de ce travail. En revanche, sur l’exemple de la figure 4, les espacements sont variables, mais pas en correspondance avec le changement d’état, et la forme des Blicks est la même avant et après. Ajoutées à ce qui a été dit précédemment sur le réinvestissement des Blicks, ces informations montrent que l’analogie permet de donner du sens à des transformations chimiques, en respectant la conservation et la non-conservation de certaines notions qui comptent pour le chimiste.